žĄúŽ°†
žä§ŪÉÄŪčī(statin)žĚÄ ÍįĄ ŽāīžóźžĄú ž†ÄŽįÄŽŹĄ žĹúŽ†ąžä§ŪÖĆŽ°§ žąėžö©ž≤īŽ•ľ ž¶ĚÍįÄžčúžľú Ūėąžē° Žāī ž†ÄŽįÄŽŹĄ žĹúŽ†ąžä§ŪÖĆŽ°§žĚĄ ž§ĄžěĄžúľŽ°úžć®, žč¨ŪėąÍīÄžßąŪôėžĚė žĚľžį®žôÄ žĚīžį® žėąŽį©žóź Ūö®Í≥ľŽ•ľ Ž≥īžĚīŽäĒ žēĹŽ¨ľŽ°ú žēĆŽ†§ž†ł žěąŽč§. ŪēėžßÄŽßĆ žĚīŪõĄ simvastatinžĚĄ žĚīžö©Ūēú žóįÍĶ¨žóźžĄú žĹúŽ†ąžä§ŪÖĆŽ°§žĚė ŽÜ掏ĄžôÄ žÉĀÍīÄžóÜžĚī Ž™®ŽĎź ž£ľžöĒ ŪėąÍīÄžßąŪôėžĚė ŽįúžÉĚŽ•†žĚĄ ÍįźžÜĆžčúŪā®Žč§Í≥† žēĆŽ†§ž†łžĄú, žĹúŽ†ąžä§ŪÖĆŽ°§ ŽĻĄžĚėž°īž†ĀžĚł Ž∂ÄÍįÄ Ūö®Í≥ľ, žėąŽ•ľ Žď§žĖī Ūē≠Ūėąž†Ą, ŪėąÍīÄ žÉĚžĄĪ, Ūē≠žóľž¶Ě, Ūē≠žāįŪôĒ Ūö®Í≥ľÍįÄ žä§ŪÉÄŪčīžĚė Ūö®Í≥ľžĚė ž§ĎžöĒŪēú žł°Ž©īžěĄžĚī ŽįĚŪėÄž°ĆŽč§.1 žä§ŪÉÄŪčīžĚÄ acetyl-CoAŽ°úŽ∂ÄŪĄį žĹúŽ†ąžä§ŪÖĆŽ°§žĚī žÉĚžĄĪŽźėŽäĒ Í≥ľž†ēžóźžĄú žÜ掏Ąž†úŪēúŪö®žÜƞ̳ ő≤-hydroxy ő≤-methylglutaryl-CoA (HMG-CoA) ŪôėžõźŪö®žÜĆŽ•ľ žĖĶž†úŪēúŽč§. Í∑ł Í≥ľž†ēžóźžĄú žÉĚžĄĪŽźėŽäĒ ž§ĎÍįĄ žāįŽ¨ľžĚł geranyl pyrophosphatežôÄ farnesyl pyrophosphatežĚī žä§ŪÉÄŪčīžóź žĚėŪēú Ž∂ÄÍįÄ Ūö®Í≥ľžôÄ ÍīÄŽ†®ŽźėžĖī žěąŽč§. 1987ŽÖĄ lovastatinžĚī ŽĮłÍĶ≠ žčĚŪíąžĚėžēĹÍĶ≠(U.S. Food and Drug Administration)žóźžĄú žäĻžĚłŪēú žĚīŪõĄ 8Íįú žĘÖŽ•ėžĚė žä§ŪÉÄŪčīžĚī ž≤ėŽį©ŽźėÍ≥† žěąŽäĒŽćį, Í≥ĶŪÜĶÍĶ¨ž°įžĚł dihydroxypentanoic acidžĚī žēĹŽ¶¨ž†Ā žěĎžö©žĚĄ ŪēėŽ©į ÍįĀÍłį Žč§Ž•ł ŽāėŽ®łžßÄ Ž∂ÄŽ∂ĄžĚī žēĹŽŹôŪēôž†Ā žĄĪžßąžĚĄ Í≤įž†ēŪēėÍ≤Ć ŽźúŽč§.
žä§ŪÉÄŪčīžĚī ŽáĆŽāīŽ°ú Žď§žĖīžė§ŽäĒ Í≥ľž†ēžĚÄ žä§ŪÉÄŪčīžĚī žąėžö©žĻúŪôĒž†Ā(hydrophilic)žĚīŽÉź, žßÄžö©žĻúŪôĒž†Ā(liphophilic)žĚīŽÉźžóź ŽĒįŽĚľ Žč§Ž•īŽč§. ŽĆÄŪĎúž†ĀžúľŽ°ú atorvastatin, lovastatin, simvastatin, fluvastatin, pitavastatinžĚÄ žßÄžö©žĻúŪôĒž†ĀžúľŽ°ú žąėŽŹôž†ĀžúľŽ°ú Ūėąžē°ŽáĆžě•Ž≤Ş̥ Ūą¨Í≥ľŪēėŽāė, žąėžö©žĻúŪôĒž†ĀžĚł pravastatin, rosuvastatinžĚÄ organic anion transporting polypeptidežôÄ ÍįôžĚÄ ŪäĻžĚī žąėžö©ž≤īŽ•ľ ŪÜĶŪēī ŽáĆ žēąžúľŽ°ú ŪÜĶÍ≥ľŽźúŽč§.2
Ž≥łŽ°†
1. žä§ŪÉÄŪčīžĚė ŽįúžěĎ žĖĶž†ú
žä§ŪÉÄŪčīžĚĄ žĚīžö©Ūēėžó¨ ŽįúžěĎ žĖĶž†úŽ†•žĚĄ žč§ŪóėŪēú ŽŹôŽ¨ľ žóįÍĶ¨ŽäĒ ŽßéŽč§. Í∑ł ž§Ď atorvastatinžĚĄ žā¨žö©Ūēú žóįÍĶ¨ÍįÄ ÍįÄžě• ŽßéžĚÄŽćį, N-methyl-D-aspartate (NMDA) žąėžö©ž≤īŽ•ľ žěźÍ∑ĻŪēėŽäĒ kainic acidŽ•ľ ž£ľžěÖŪēėžó¨ ŽįúžěĎ žú†Žįú ž†Ą 7žĚľ ŽŹôžēą 10 mg/kgŽ•ľ Ūą¨žó¨ŪēėŽ©ī, ŽįúžěĎ žú†Žįú 1‚Äď2žčúÍįĄ žĚīŪõĄžóź ŽįúžÉĚŪēėŽäĒ ŽįúžěĎžĚė ŪöüžąėÍįÄ ŽĆÄž°įÍĶįžóź ŽĻĄŪēī ÍįźžÜĆŪēėÍ≤Ć ŽźúŽč§.3 ŪĚ•ŽĮłŽ°≠Í≤ĆŽŹĄ žä§ŪÉÄŪčīžĚĄ ŽįúžěĎ žú†Žįú žĚīŪõĄžóź ž£ľžěÖŪĖąžĚĄ ŽēĆŽäĒ ŽįúžěĎ žĖĶž†úŪö®Í≥ľÍįÄ žóÜžóąŽč§. AtorvastatinžĚÄ pentylene tetrazolžĚīŽāė quinolinic acid4Ž°ú žú†ŽįúŽźú ŽįúžěϞ󟞥úŽŹĄ ÍįôžĚÄ žĖĶž†úŪö®Í≥ľŽ•ľ Ž≥īžėÄŽč§. Í∑ł žôłžĚė žä§ŪÉÄŪčīžúľŽ°ú lovastatin, simvastatinžĚī kainic acid žú†Žįú ŽįúžěϞ̥ žĖĶž†úŪēėŽäĒ Ūö®Í≥ľŽ•ľ Ž≥īžėÄžúľŽ©į, ŽĮłÍĶ≠ ÍĶ≠Ž¶ĹŽ≥īÍĪīžõź(U.S. National Institution of Health)žĚė ŽįúžěĎ žĖĶž†úž†ú žä§ŪĀ¨Ž¶¨ŽčĚ ŪĒĄŽ°úŪ܆žĹúžĚė ŪēĶžč¨Ž™®ŽćłžĚł audiogenic seizure Ž™®ŽćłžĚĄ žĚīžö©Ūēú žóįÍĶ¨žóźžĄú ŽĆÄŽ∂ÄŽ∂ĄžĚė žä§ŪÉÄŪčīžĚī ŽįúžěĎ žĖĶž†úŪö®Í≥ľŽ•ľ ŽāėŪÉÄŽÉąŽč§.
2. žä§ŪÉÄŪčīžĚė ŽáĆž†Ąž¶Ě ŽįúžÉĚ žĖĶž†ú
ŽáĆž†Ąž¶ĚžĚÄ Ūēú žąúÍįĄžóź žÉĚÍłįŽäĒ Í≤ÉžĚī žēĄŽčąÍ≥†, Žč§žĖĎŪēú ŽáƞܟžÉĀ žĚīŪõĄ ŽáĆžč†Í≤Ĺ ž°įžßĀžĚī ŽįúžěĎžóź žú†Ž¶¨Ūēú ŪôėÍ≤Ĺ, ž¶Č ŽįúžěĎžĚė žó≠žĻėŽ•ľ Žāģž∂ĒŽäĒ Žį©ŪĖ•žúľŽ°ú žĄúžĄúŪěą Ž≥ÄŪēīÍįÄŽč§ÍįÄ žĖīŽäź ž†ēŽŹĄŽ•ľ ŽĄėžĖīžĄúŽ©ī žěźŽįúž†ĀžĚł ŽįúžěĎžĚī ŽįėŽ≥ĶŽźėŽäĒ žÉĀŪô©žĚī ŽźėÍ≤Ć ŽźúŽč§. ŪėĄžě¨ÍĻĆžßÄ žā¨Žěƞ󟞥ú ŽáĆž†Ąž¶Ě ŽįúžÉ̞̥ žĖĶž†úŪēúŽč§ŽäĒ ž¶ĚÍĪįŽ•ľ ÍįĞߥ žĖīŽĖ†Ūēú žēĹž†úŽŹĄ ÍįúŽįúŽźėžßÄ Ž™ĽŪĖąŽč§. ŽáĆžóź ŪôĒŪēôžěźÍ∑Ļ ŽėźŽäĒ ž†ĄÍłįžěźÍ∑Ļ ŽďĪžĚĄ ž£ľÍ≥† žąėž£ľ ŽėźŽäĒ žąėÍįúžõĒ ŪõĄ ŽįúžÉĚŪēėŽäĒ žěźŽįú ŽįúžěĎŽ™®Žćł žč§ŪóėžĚÄ žĖīŽ†§žöī ž†źžĚī ŽßéŽč§. žč§ŪóėÍłįÍįĄžĚī ÍłłžĖī žě•ÍłįÍįĄ ŽŹôžēąžĚė Ž™®ŽčąŪĄįŽßĀžĚī ŪēĄžöĒŪēėÍ≥†, ŽįúžěĎ žąėÍįÄ ž∂©Ž∂ĄŪěą ŽßéžēĄžēľ žēĹŪö®Ž•ľ ŽĻĄÍĶźŪē† žąė žěąžúľŽ©į, ŽįúžěĎžĚī Í∑úžĻôž†ĀžúľŽ°ú ŽįúžÉĚŪēėŽäĒ Í≤ÉžĚī žēĄŽčąŽĮÄŽ°ú(clustering)5 Í≤įÍ≥ľ ŪēīžĄĚ žčú žú†žĚėŪēėžó¨žēľ ŪēúŽč§.
WAG/Rij ž•ź Ž™®ŽćłžĚÄ Í≤įžč†ŽáĆž†Ąž¶ĚžĚė žú†ž†Ąžěź ŽŹôŽ¨ľŽ™®ŽćłžĚłŽćį, žä§ŪÉÄŪčīžĚĄ 17ž£ľ Ūą¨žó¨ŪēėÍ≥† 5ÍįúžõĒ ŪõĄ ŽáĆŪĆĆŽ°ú Í∑ĻžĄúŪĆĆ(spike and wave)žĚė žąėŽ•ľ ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆ, ŽĆÄž°įÍĶįžóź ŽĻĄŪēī atorvastatinÍ≥ľ simvastatin Ūą¨žó¨ÍĶįžóźžĄú ŪėĄž†ÄŪěą ž†ĀžóąŽč§. Ūą¨žó¨ŽüČžóź ŽĒįŽĚľ Í≤įÍ≥ľžóź žį®žĚīÍįÄ Žā¨ŽäĒŽćį, atorvastatin 5 mg/kgžóźŽäĒ ŽĆÄž°įÍĶįÍ≥ľ žĚėŽĮłžěąŽäĒ žį®žĚīÍįÄ žóÜžóąžúľŽāė 10 mg/kgžóźžĄúŽäĒ Ūö®Í≥ľŽ•ľ Ž≥īžėÄŽč§.6 žįłÍ≥†Ž°ú 10 mg/kgžĚė žö©ŽüČžĚÄ žěĄžÉĀžóźžĄú ŪôėžěźžóźÍ≤Ć ž≤ėŽį©ŪēėŽäĒ ÍłįŽ≥ł žö©ŽüȞ̳ 10 mgžĚė 10Žįį ž†ēŽŹĄžóź ŪēīŽčĻŪēėŽäĒ žö©ŽüČžĚīŽč§. žä§ŪÉÄŪčīžĚė Ūą¨žó¨ ÍłįÍįĄŽŹĄ ž§ĎžöĒŪēú Í≥†Ž†§žā¨Ūē≠žĚīŽč§. Kainic acidŽ°ú žĚľž†ē ÍłįÍįĄ ŽįúžěĎ žßÄžÜćžÉĀŪÉúŽ•ľ žú†žßÄŪēú 4‚Äď6ÍįúžõĒ ŪõĄžĚė ŽáĆŪĆĆ Ž™®ŽčąŪĄįŽßĀ žč§ŪóėžóźžĄú simvastatinžĚĄ žīąÍłį 14žĚľŽßĆ Ūą¨žó¨ŪēėÍ≥†ŽŹĄ Í∑ĻŪĆĆžĚė žąėÍįÄ ŽĆÄž°įÍĶįžóź ŽĻĄŪēī žĚėŽĮł žěąÍ≤Ć ž§ĄžĖīŽď§žóąŽč§.7 ŪēėžßÄŽßĆ Žč§Ž•ł žóįÍĶ¨žóźžĄú atorvastatinžĚĄ ž†ĄÍłįžěźÍ∑Ļ žú†Žįú ŽįúžěĎ žßÄžÜćžÉĀŪÉú ž†ĄŪõĄ 14žĚľÍįĄ Ūą¨žó¨ŪēėÍ≥† 6ž£ľ ŪõĄ ŽáĆŪĆĆŽ•ľ Ž™®ŽčąŪĄįŽßĀŪēėžėĞ̥ ŽēĆ ŽįúžěĎžĚī ž§ĄžßÄ žēäŽč§ŽäĒ Í≤įÍ≥ľŽŹĄ žěąžúľŽĮÄŽ°ú,8 Ūą¨žó¨ žö©ŽüČ Ž™ĽžßÄžēäÍ≤Ć Ūą¨žó¨ ÍłįÍįĄŽŹĄ ž§ĎžöĒŪēú žč§Ūóėž†Ā, žěĄžÉĀž†Ā Í≥†Ž†§žā¨Ūē≠žĚī ŽźėÍ≤†Žč§.
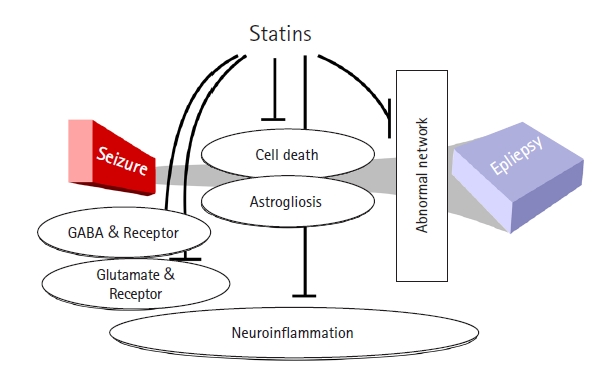
3. žä§ŪÉÄŪčīžĚė ŽįúžěĎ ŽįúžÉĚ žĖĶž†úžôÄ ŽáĆž†Ąž¶Ě ŽįúžÉĚ žĖĶž†ú Íłįž†Ą
žä§ŪÉÄŪčīžĚė ŽįúžěĎ žĖĶž†ú Íłįž†Ą ž§Ď ŪēėŽāėŽäĒ, ŪĚ•Ž∂ĄžĄĪ žč†Í≤Ĺž†ĄŽč¨Ž¨ľžßąžĚł glutamatežôÄ Í∑ł žąėžö©ž≤īžĚė ÍįźžÜĆ ŽįŹ žĖĶž†úžĄĪ Ž¨ľžßąžĚł GABA (ő≥-aminobutyric acid)žôÄ Í∑ł žąėžö©ž≤īžĚė ž¶ĚÍįÄžĚīŽč§. Í∑ł žôłžóź žč†Í≤Ĺžóľž¶Ě ŽįėžĚĎŽŹĄ ŽįúžěĎ ž†ĄŪõĄžóź ž¶ĚÍįÄŪēėŽäĒŽćį, ŽáĆ ŽāīžĚė žóľž¶ĚžĄĪ žā¨žĚīŪ܆žĻīžĚł ž¶ĚÍįÄžôÄ, ŽßźžīąŪėąžē°žúľŽ°úŽ∂ÄŪĄį ŽáĆŽ°ú ž†ĄŽč¨ŽźėŽäĒ žóľž¶ĚžĄłŪŹ¨žĚė ŽŹôžõźžĚī Ž™®ŽĎź ÍīÄžó¨ŪēúŽč§. žóľž¶ĚžĄĪ žā¨žĚīŪ܆žĻīžĚł, žėąŽ•ľ Žď§žĖī interleukin (IL)-betaŽäĒ COX-2žôÄ Ūē®ÍĽė NMDA žąėžö©ž≤īžĚė ž¶ĚÍįÄŽ•ľ žĚľžúľžľú ŽįúžěĎ žú†Žįú ŽįŹ žēÖŪôĒžóź ÍīÄžó¨ŪēúŽč§. žč§Ūóėž†ĀžúľŽ°ú ŽįúžěĎ žßÄžÜćžÉĀŪÉúŽ•ľ žú†ŽįúŪēėÍ≤Ć ŽźėŽ©ī, žĄłŪŹ¨žā¨žôÄ žēĄÍĶźžĄłŪŹ¨ž¶ĚÍįÄÍįÄ žĚľžĖīŽāėÍ≥† žĚīžÉĀ žč†Í≤Ĺ ŽĄ§ŪäłžõĆŪĀ¨ÍįÄ ŪėēžĄĪŽźúŽč§.6,9 žĚīŽüį ÍĶ¨ž°įž†ĀžĚł Ž≥ÄŪôĒŽ°ú žĚłŪēī žěźŽįú ŽįúžěĎžĚė žėĀžó≠, ž¶Č ŽáĆž†Ąž¶ĚžĚī ŽßƎ吏ĖīžßÄÍ≤Ć ŽźėŽäĒŽćį, žĚī Í≥ľž†ēžóź žä§ŪÉÄŪčīžĚī ÍīÄžó¨ŪēėÍ≤Ć ŽźúŽč§(Fig. 1).
1) žč†Í≤Ĺž†ĄŽč¨Ž¨ľžßąžóź žěĎžö©
žä§ŪÉÄŪčīžĚī žĹúŽ†ąžä§ŪÖĆŽ°§ žąėžĻėŽ•ľ Žāģž∂§žúľŽ°úžć® žĄłŪŹ¨ŽßČ žĄĪŽ∂Ą Ž≥ÄŪôĒŽ•ľ žĚľžúľžľú NMDA Žß§ÍįúžĄĪ ŪĚ•Ž∂Ą ŽŹÖžĄĪÍ≥ľ AMPA žąėžö©ž≤ī(őĪ-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor)žĚė ÍłįŽä• ž†ÄŪēėŽ•ľ žĚľžúľŪā¨ žąė žěąŽč§.10 ŽėźŪēú žä§ŪÉÄŪčīžĚÄ ž§ĎÍįĄ žāįŽ¨ľžĚł isoprenoid Ūē©žĄĪžĚĄ ž†ÄŪēīŪē®žúľŽ°úžć®, GTPase žč†Ūėłž≤īÍ≥ĄŽ•ľ Žį©ŪēīŪēúŽč§.11 ŪēėžßÄŽßĆ žä§ŪÉÄŪčīžóź žĚėŪēú ŽáĆ Žāī žĹúŽ†ąžä§ŪÖĆŽ°§žĚė Ž≥ÄŪôĒŽäĒ Žß§žöį ŽĮłŽĮłŪēėžó¨, žĹúŽ†ąžä§ŪÖĆŽ°§žĚė ŽáĆ Žāī ŽÜ掏Ą žěźž≤īžĚė Ž≥ÄŪôĒÍįÄ ŪĀ¨Í≤Ć žěĎžö©ŪēėžßÄŽäĒ žēäžĚĄ Í≤ÉžĚīŽĚľŽäĒ Í≤ÉžĚī ž†ēžĄ§žĚīŽč§. žä§ŪÉÄŪčīžĚÄ žčúŽÉÖžä§(synapse)žóźžĄú glutamatežĚė žě¨ŪĚ°žąėŽ•ľ ŪöĆŽ≥Ķžčúžľú ŪĚ•Ž∂ĄžĄĪžĚĄ ÍįźžÜĆžčúŪā®Žč§.
2) žĄłŪŹ¨ Ž≥īŪėł Ūö®Í≥ľ
ŽįúžěĎ žú†Žįúžóź ŽĒįŽ•ł ŪēīŽßąžĚė žĄłŪŹ¨žā¨Ž•ľ žä§ŪÉÄŪčīžĚī žĖĶž†úŪēėŽäĒ Ūö®Í≥ľÍįÄ žěąŽč§. Kainic acid3,7 Ž™®ŽćłÍ≥ľ quinolonic acid4 Ž™®ŽćłžóźžĄú atorvastatin ŽėźŽäĒ simvastatinžĚī ŽįúžěĎ žú†Žįúžóź ŽĒįŽ•ł žĄłŪŹ¨žā¨Ž•ľ ž§ĄžĚīŽäĒ Ūö®Í≥ľŽ•ľ Ž≥īžėÄŽč§. žĄłŪŹ¨žā¨ÍįÄ žěźŽįú ŽįúžěĎ, ž¶Č ŽáĆž†Ąž¶Ě ŽįúžÉĚžĚė ŪēĄžąė ž°įÍĪīžĚÄ žēĄŽčąžßÄŽßĆ, žä§ŪÉÄŪčīžóź žĚėŪēú žĄłŪŹ¨ Ž≥īŪėł Ūö®Í≥ľŽäĒ žĚīŪõĄžóź ŽįúžÉĚŪēėŽäĒ ŽįúžěĎŪĆĆžĚė žĖϞ̥ ž§ĄžĚīŽäĒ Žćįžóź ÍīÄžó¨Ūē† Í≤ÉžúľŽ°ú ž∂Ēžł°ŽźúŽč§. žä§ŪÉÄŪčīžĚė žĄłŪŹ¨ Ž≥īŪėł Ūö®Í≥ľžóźŽäĒ žĄłŪŹ¨žěźŽ©łžā¨Ž•ľ žú†ŽįúŪēėŽäĒ Mst1žĚė žĖĶž†úÍįÄ ÍīÄžó¨ŪēėÍ≥†,12 glial cell-derived neurotrophic factoržôÄ ÍįôžĚÄ žč†Í≤ĹžėĀžĖϞ̳žěź(neurotrophic factor)žĚė ž¶ĚÍįÄŽŹĄ Íłįž†ĄžĚė ŪēėŽāėŽ°ú ž†úžčúŽźėžóąŽč§.13 PI3K/Akt žĚłžāįŪôĒŽäĒ žĄłŪŹ¨žĚė žÉĚž°īÍ≥ľ ž¶ĚžčĚžóź ž§ĎžöĒŪēú žč†Ūėłž†ĄŽč¨ž≤īÍ≥ĄžĚłŽćį, žä§ŪÉÄŪčīžĚī žĚīŽ•ľ ž¶ĚÍįÄžčúŪā§Ž©į žĄłŪŹ¨žěźŽ©łžā¨žôÄ žóįÍīÄŽźėŽäĒ Bax, caspase3 ŽďĪžĚė žú†ž†Ąžěź ŽįúŪėĄžóź žėĀŪĖ•žĚĄ ŽĀľžĻúŽč§.4,14
3) žßÄžßą Í≥ľžāįŪôĒ(lipid peroxidation) žĖĶž†ú
žěźžú† ŽĚľŽĒĒžĻľ(free radical)žĚÄ žĄłŪŹ¨ŽßȞ󟞥ú ž†ĄžěźŽ•ľ ŽĻľžēóžēĄ žĄłŪŹ¨ žÜźžÉĀžĚĄ žĚľžúľŪā§ŽäĒŽćį, žä§ŪÉÄŪčīžĚÄ žāįŪôĒ ŪėēŪÉúžĚė ͳĎ£®ŪÉÄžĻėžė®(glutathione)žĚĄ ž¶ĚÍįÄžčúžľú žßÄžßąÍ≥ľžāįŪôĒŽ•ľ žĖĶž†úŪē®žúľŽ°úžć® žĄłŪŹ¨žā¨Ž•ľ žĖĶž†úŪēúŽč§.9 ŽėźŪēú žāįŪôĒžßąžÜĆ(nitric oxide)ŽäĒ ž†ÄŽÜ掏ĄžóźžĄú ŽĆÄÍįú žěźžú† ŽĚľŽĒĒžĻľžĚĄ ž≤≠žÜĆŪēėŽäĒ ÍłįŽä•žĚĄ ŽčīŽčĻŪēėŽäĒŽćį, žä§ŪÉÄŪčīžĚÄ ŪėąÍīÄ ŽāīŪĒľžĄłŪŹ¨, ŪŹČŪôúÍ∑ľžĄłŪŹ¨, žēĄÍĶźžĄłŪŹ¨žóźžĄú žāįŪôĒžßąžÜĆ Ūē©žĄĪŪö®žÜĆ(nitric oxide synthase)Ž•ľ ž¶ĚÍįÄžčúŪā§Í≥†, žĚīŽ°ú žĚłŪēī žāįŪôĒžßąžÜĆŽ•ľ ŽäėŽ¶¨ŽäĒ Ūö®Í≥ľÍįÄ žěąŽč§.15
4) ͳ϶¨žĹĒÍ≤ź žÉĚžĄĪŪö®žÜĆ žĚłžāįŪôĒŪö®žÜĆ 3ő≤ (glycogen synthase kinase-3ő≤)
ͳ϶¨žĹĒÍ≤ź žÉĚžĄĪŪö®žÜĆ žĚłžāįŪôĒŪö®žÜĆ 3ő≤ (glycogen synthase kinase-3ő≤, GSK-3ő≤)ŽäĒ žč†Í≤ĹžĄłŪŹ¨žĚė Í∑ĻžĄĪžĚĄ Í≤įž†ēŪēėŽäĒ ž§ĎžöĒŪēú Ž∂ĄžěźžĚīŽ©īžĄú žč†Í≤ĹžĄłŪŹ¨žĚė žÉĚž°īÍ≥ľ ž∂ēžā≠ŽŹĆÍłį(axon)žĚė žĄĪžě•žóź ÍīÄžó¨ŪēėŽäĒŽćį, ŽįúžěϞ̥ žú†ŽįúŪēėŽ©ī žĚī Žč®ŽįĪžßąžĚė žĖĎžĚė ž¶ĚÍįÄŪēėŽĮÄŽ°ú ŽáĆž†Ąž¶Ě žĻėŽ£ĆžĚė Ž™©ŪĎú ž§Ď ŪēėŽāėŽ°ú žóįÍĶ¨ÍįÄ žßĄŪĖČŽźėÍ≥† žěąŽč§. žä§ŪÉÄŪčīžĚÄ ŽįúžěĎ ŪõĄ GSK-3ő≤žĚė ž¶ĚÍįÄŽ•ľ žĖĶž†úŪēúŽč§.16
5) žč†Í≤Ĺžóľž¶Ě žĖĶž†ú
žä§ŪÉÄŪčīžĚÄ žč†Í≤Ş󾞶̞̥ žĖĶž†úŪēėŽäĒ Ūö®Í≥ľÍįÄ žěąŽč§. žč†Í≤Ş󾞶ĚÍ≥ľ ŽáĆž†Ąž¶Ě ŽįúžěϞ̥ Ž™®ŽĎź Žč§Ž£®ÍłįžóźŽäĒ žßÄŽ©īžĚė ž†úŪēúžĚī žěąžĖī, ÍįĄŽč®ŪēėÍ≤Ć žĄ§Ž™ÖŪēėÍ≥†žěź ŪēúŽč§. žč†Í≤Ş󾞶̞ĚÄ žč†žÜćŪēú ŽįėžĚĎžúľŽ°ú ŪĚ•Ž∂ĄžĄĪ žĚīžė®ŪÜĶŽ°úŽ•ľ ž¶ĚÍįÄžčúžľú ŽįúžěĎ ŽįúžÉĚžóź Íłįžó¨ŪēėÍ≥†, žě•Íłįž†ĀžĚł ŽįėžĚĎžúľŽ°ú nuclear factor kappa-BžĚė ž¶ĚÍįÄŽ•ľ ŪÜĶŪēī žč†Í≤ĹžĄłŪŹ¨žĚė ÍĶ¨ž°įž†Ā‚ÄßÍłįŽä•ž†Ā Ž≥ÄŪôĒŽ•ľ žĚľžúľžľú ŽáĆž†Ąž¶Ě ŪėēžĄĪžóź Íłįžó¨ŪēúŽč§.17 žč†Í≤Ĺžóľž¶Ě ŽįėžĚϞ̥ ŪĀ¨Í≤Ć žúĄžĻėžóź ŽĒįŽĚľ 2ÍįúŽ°ú ÍĶ¨Ž∂ĄŪēėŽ©ī ŽáĆ Žāī ŽįėžĚĎÍ≥ľ ŽßźžīąŽŹôžõź ŽįėžĚĎžúľŽ°ú ŽāėŽąĆ žąė žěąŽäĒŽćį, žä§ŪÉÄŪčīžĚÄ ŽĎź ÍĶįŽćį Ž™®ŽĎź žĖĶž†úŪēúŽč§. Pilocarpine žú†Žįú ŽįúžěĎ žßÄžÜ掙®ŽćłžóźžĄú ŪēīŽßą ž°įžßĀžĚė žā¨žĚīŪ܆žĻīžĚł mRNAŽ•ľ žł°ž†ēŪēėžėĞ̥ ŽēĆ, ŽáĆž†Ąž¶ĚžĚī ŽįúžÉĚŪēėÍłį ž†Ą, ž¶Č ŽáĆž†Ąž¶Ě žě†Ž≥ĶÍłįžóź žóľž¶ĚžĄĪ žā¨žĚīŪ܆žĻīžĚłžĚł IL-1ő≤, tumor necrosis factor őĪ, IL-6ÍįÄ ž¶ĚÍįÄŪēėŽäĒŽćį, žĚīŽäĒ žč†Í≤Ş󾞶̞Ěī ŽáĆž†Ąž¶Ě ŽįúžÉĚžóź Íłįžó¨ŪēúŽč§ŽäĒ ž¶ĚÍĪįÍįÄ ŽźúŽč§. Lovastatin 20 mg/kgŽ•ľ Ūą¨žó¨Ūēú ÍĶįžóźžĄúŽäĒ žóľž¶ĚžĄĪ žā¨žĚīŪ܆žĻīžĚłžĚī ž¶ĚÍįÄŪēėžßÄ žēäžēėŽč§.18
ŽįúžěĎ žú†Žįú žčúžóź žľÄŽ™®žĻīžĚł(chemokine) Ž∂ĄŽĻĄÍįÄ ž¶ĚÍįÄŪēėÍ≥†, žĚīŽ°ú žĚłŪēī ŽßźžīąŪėąžē°žóźžĄú ŽáĆ ž™ĹžúľŽ°ú Žč®ŪēĶÍĶ¨žĚė žĚīŽŹôžĚī žĚľžĖīŽāėžĄú Žáƞ󾞶̞Ěī ÍįÄž§ĎŽźúŽč§. žä§ŪÉÄŪčīžĚÄ žľÄŽ™®žĻīžĚłžĚė Ž∂ĄŽĻĄŽ•ľ žĖĶž†úŪēėÍ≥†, Ūėąžē°ŽáĆžě•Ž≤ĹžĚė Ūą¨Í≥ľŽ•ľ žĖĶž†úŪēėŽäĒ Ūö®Í≥ľÍįÄ žěąŽč§.19 ŽßźžīąŪėąžē°žĚė ŽįĪŪėąÍĶ¨ÍįÄ ŽáĆ žēąžúľŽ°ú žĚīŽŹôŪēėÍłį žúĄŪēīžĄúŽäĒ ŪėąÍīÄ ŽāīŪĒľžĄłŪŹ¨žôÄžĚė ž†ĎžīČ, ž¶Č ŽįĪŪėąÍĶ¨žĚė őĪ4-intergrinÍ≥ľ ŪėąÍīÄ ŽāīŪĒľžĄłŪŹ¨žĚė vascular cell adhesion protein 1žĚė ž†ĎžīČžĚī ŪēĄžöĒŪēėŽč§. ŽßźžīąŪėąžē°žóźžĄú ŽŹôžõźŽźėŽäĒ žóľž¶ĚžĄłŪŹ¨ŽäĒ ŽáĆž†Ąž¶Ě ŽįúžěĎÍ≥ľ ÍłīŽįÄŪēú žóįÍīÄžĄĪžĚī žěąŽäĒŽćį, žĶúÍ∑ľ őĪ4-intergrinžĚė Ūē≠ž≤īžĚł natalizumabžĚė ŽáĆž†Ąž¶Ě Ūö®Í≥ľžóź ŽĆÄŪēú 2žÉĀ žěĄžÉĀžóįÍĶ¨ Í≤įÍ≥ľ, žúĄžēĹžóź ŽĻĄŪēī ‚Äď14.4%žĚė ŽįúžěĎ žĖĶž†úŪö®Í≥ľŽ•ľ Ž≥īžėÄŽč§.20
4. žěĄžÉĀžóįÍĶ¨ŽäĒ žĖīŽĒĒÍĻĆžßÄ žôĒŽäĒÍįÄ?
žä§ŪÉÄŪčīžĚė ŽáĆž†Ąž¶Ě ŽįúžěĎ ÍīÄŽ†® žěĄžÉĀžóįÍĶ¨Ž°úŽäĒ ŪėĄžě¨ÍĻĆžßÄ žīĚ 12ÍįúžĚė žĹĒŪėłŪäł žóįÍĶ¨ÍįÄ žěąŽč§. Í∑ł ŽĆÄžÉĀžĚÄ ŽáĆž°łž§Ď ŪõĄ ͳȞĄĪŽįúžěĎ ŽėźŽäĒ ŽáĆž†Ąž¶Ě, ŽáĆžĘÖžĖĎ ŪõĄ ŽáĆž†Ąž¶Ě, ŽáĆž∂úŪėą ŪõĄ ŽįúžěĎžĚī žóįÍĶ¨ŽĆÄžÉĀžĚīžóąŽč§. žóįÍĶ¨ ž§ĎžĚł ž£ľžöĒ žóįÍĶ¨Ž•ľ ž§Ďžč¨žúľŽ°ú žāīŪéīŽ≥īŽŹĄŽ°Ě ŪēėÍ≤†Žč§.
1) ŽáĆž°łž§Ď ŪõĄ ͳȞĄĪŽįúžěĎ/ŽáĆž°łž§Ď ŪõĄ ŽáĆž†Ąž¶Ě(poststroke seizure/poststroke epilepsy)
ͳȞĄĪÍłįžĚė ŽáĆŪóąŪėąžĚÄ žĄłŪŹ¨ŽßČžĚė žÜźžÉĀžĚĄ žĚľžúľžľú žÜĆŽĒĒžõÄ ŪÜĶŽ°ú, žĻľžäė ŪÜĶŽ°úžĚė Ž≥ÄŪôĒŽ•ľ žĚľžúľŪā§Ž©į, ž†ĄŪēīžßąžĚė Ūē≠žÉĀžĄĪžĚĄ ÍĻ®Žú®Ž†§žĄú ŽįúžěϞ̥ žĚľžúľŪā®Žč§. žĚīŪõĄ žě¨ÍīÄŽ•ėÍįÄ žĚľžĖīŽāėŽ©ī, žāįŪôĒ žä§Ū䳎†ąžä§žôÄ Ūē®ÍĽė Ūėąžē°ŽáĆžě•Ž≤ĹžĚī ÍĻ®ž†łžĄú Žßźžīą žóľž¶ĚžĄłŪŹ¨Žď§žĚė ŽáĆ Žāī žĻ®Ūą¨ÍįÄ žĚľžĖīŽāėŽäĒŽćį, žĚīŽ•ľ ŪóąŪėą ŪõĄ ͳȞĄĪŽįúžěĎžĚė Íłįž†ĄžúľŽ°ú žĄ§Ž™ÖŪēúŽč§. ŽáĆž∂úŪėąžĚė Í≤ĹžöįžóźŽäĒ Ūėąžē°žĄłŪŹ¨ žĄĪŽ∂ĄžĚė žßĀž†Ďž†ĀžĚł žč†Í≤ĹžĄłŪŹ¨ žěźÍ∑ĻŽŹĄ ŽįúžěĎ ŽįúžÉĚ Íłįž†ĄžĚė ŪēėŽāėžĚīŽč§.21
2,969Ž™ÖžĚė ͳȞĄĪ ŽáĆÍ≤ĹžÉČ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú žä§ŪÉÄŪčī žā¨žö©žěźžôÄ ŽĻĄžā¨žö©žěźŽ•ľ propensity scoring matchingŪēėžó¨ žĻėŽ£ĆÍĶį 886Ž™Ö ŽĆÄ ŽĻĄžĻėŽ£ĆÍĶį 886Ž™ÖžĚĄ 1:1Ž°ú ŽĻĄÍĶźŪēėžėĞ̥ ŽēĆ, žä§ŪÉÄŪčī žā¨žö©žěźžóźžĄú ͳȞĄĪÍłį ŽįúžěĎžĚī ž†ĀÍ≤Ć ŽāėŪÉÄŽā¨Žč§(odds ratio [OR], 0.23; P < 0.001).22 1,832Ž™ÖžĚė ŽáĆž°łž§Ď ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú ŽáĆž°łž§Ď ŽįúžÉĚ žĚīŪõĄ 3žĚľ žĚīŽāīžóź žčúžěĎŪēėžó¨ žīĚ 3žĚľ žĚīžÉĀžĚė žä§ŪÉÄŪčīžĚĄ žā¨žö©ŪēėÍ≥† ŪŹČÍ∑† 2.5ŽÖĄžĚĄ ÍīÄžįįŪēú žóįÍĶ¨žóźžĄú, žä§ŪÉÄŪčīžĚĄ žā¨žö©ŪēėžėĞ̥ ŽēĆ ÍłČžĄĪŽįúžěĎžĚī ÍįźžÜĆŪēėžėÄÍ≥†(OR, 0.36) ͳȞĄĪÍłį ŽįúžěϞ̥ Í≤ĹŪóėŪēú ŪôėžěźžĚė Í≤ĹžöįžóźŽäĒ žä§ŪÉÄŪčīžĚĄ žďįŽ©ī ŽßĆžĄĪÍłį ŽįúžěĎ, ž¶Č ŽáĆž†Ąž¶Ě ŽįúžÉĚŽŹĄ žĖĶž†úŽź®žĚĄ ŪôēžĚłŪēėžėÄŽč§(OR, 0.34).23 žĚī žóįÍĶ¨žóźžĄúŽäĒ 96%žĚė ŪôėžěźÍįÄ žä§ŪÉÄŪčīžúľŽ°ú atorvastatinžĚĄ žā¨žö©ŪēėžėÄŽč§. 477Ž™ÖžĚė ŽáĆÍ≤ĹžÉČ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú Žėź Žč§Ž•ł žóįÍĶ¨žóźžĄú, 3žĚľ žĚīŽāīžĚė žä§ŪÉÄŪčīžúľŽ°ú žĻėŽ£ĆŪēú ÍĶįžĚĄ 12ÍįúžõĒÍįĄ ž∂Ēž†Ā ÍīÄžįįŪēú Í≤įÍ≥ľ žä§ŪÉÄŪčīžĚė ŽáĆž†Ąž¶Ě ŽįúžÉĚŽ•† žį®žĚīÍįÄ žě¨žį® ŪôēžĚłŽźėžóąŽč§(OR, 0.28; P = 0.0012).24,25
2) ŽáĆž°łž§Ď žôł ŽáĆž†Ąž¶Ě žóįÍĶ¨
žä§ŪÉÄŪčīžĚī ŽáĆÍ≤ĹžÉČžĚė žě¨ŽįúžĚĄ žĖĶž†úŪēėŽĮÄŽ°ú,25,26 ŽáĆž†Ąž¶ĚžĚė ŽįúžěĎ žĖĶž†ú ŽįŹ ŽáĆž†Ąž¶Ě ŽįúžÉĚ žĖĶž†úŪö®Í≥ľŽ•ľ Í≥†Ž†§ŪēėžßÄ žēäŽäĒŽč§Í≥† ŪēīŽŹĄ žä§ŪÉÄŪčīžĚė Ūą¨žó¨ŽäĒ ŽáĆÍ≤ĹžÉČ žĻėŽ£Ćžóź ŪēĄžąėžöĒžÜĆžĚīŽč§. ŪēėžßÄŽßĆ, ͳȞĄĪ ŽáĆÍ≤ĹžÉČžĚī žēĄŽčĆ ŽáĆž†Ąž¶Ě ŪôėžěźÍĶįžóźžĄúŽŹĄ žä§ŪÉÄŪčīžĚī žú†žö©Ūē†ÍĻĆ? ž†Ąžó≠ ÍĶįžĚłŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú Ūēú žě•Íłįž∂Ēž†Ā žĹĒŪėłŪäł žóįÍĶ¨27žóźžĄú 1,843Ž™ÖžóźÍ≤Ć ŽáĆž†Ąž¶ĚžĚī ŽįúžÉĚŪēėžėÄÍ≥† 1,023,376Ž™ÖžĚÄ ŽįúžÉĚŪēėžßÄ žēäžēėŽäĒŽćį, ŽáĆž†Ąž¶Ě ŽįúžÉĚÍĶįžóźžĄúŽäĒ žä§ŪÉÄŪčī žā¨žö©žěźÍįÄ 21.3%, ŽĻĄŽįúžÉĚÍĶįžóźžĄúŽäĒ 30.3%Ž°ú žä§ŪÉÄŪčī žā¨žö©žěźžĚė ŽáĆž†Ąž¶Ě ŽįúžÉĚŽ•†žĚī ž†ĀžóąŽč§(OR, 0.65).2 150,555Ž™ÖžĚė ÍīÄžÉĀŽŹôŽß• žě¨ÍīÄŽ•ė žĻėŽ£ĆŽ•ľ ŽįõžĚÄ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú žßĄŪĖČŽźú ž¶ĚŽ°Ä ŽĆÄž°įÍĶį(nested case-control)žóįÍĶ¨28ŽäĒ 217Ž™ÖžĚė žä§ŪÉÄŪčī žā¨žö©žěźžôÄ 2,170Ž™ÖžĚė Žß§žĻ≠ ŽĆÄž°įÍĶįžĚĄ ŽĻĄÍĶźŪēėžėÄŽäĒŽćį, žä§ŪÉÄŪčīžĚī ŽáĆž†Ąž¶ĚžúľŽ°ú žĚłŪēú žěÖžõź žúĄŪóėŽŹĄŽ•ľ ÍįźžÜĆžčúžľįŽč§(adjusted risk ratio, 0.65). ŽėźŪēú 143Ž™ÖžĚĄ ŽĆÄžÉĀžúľŽ°ú Ūēú ŽáĆž†Ąž¶ĚžßÄžÜćžÉĀŪÉú Ž†ąžßÄžä§Ū䳎¶¨ žóįÍĶ¨žóźžĄúŽŹĄ žä§ŪÉÄŪčīžĚÄ žā¨ŽßĚŽ•†žĚĄ ÍįźžÜĆžčúžľįŽč§(relative risk reduction, 0.38).29 ŪēėžßÄŽßĆ, 1,149,384Ž™ÖžĚė žä§ŪÉÄŪčī Ūą¨žó¨žěźŽßƞ̥ ŽĆÄžÉĀžúľŽ°ú Ūēú žĚłÍĶ¨ ÍłįŽįė žóįÍĶ¨žóźžĄú žä§ŪÉÄŪčīžĚĄ žā¨žö©Ūē† ŽēĆžôÄ žā¨žö©ŪēėžßÄ žēäžēėžĚĄ ŽēĆŽ•ľ ŽĻĄÍĶźŪĖąžĚĄ ŽēĆ ŽįúžěĎžĚė žį®žĚīŽäĒ žóÜžóąŽč§. žĚī žóįÍĶ¨ŽäĒ žä§ŪÉÄŪčīžĚĄ žā¨žö©Ūē† ŽēĆžôÄ žā¨žö©ŪēėžßÄ žēäžĚĄ ŽēĆŽ•ľ ÍįúžĚł ŽāīžóźžĄú ŽĻĄÍĶźŪēú žóįÍĶ¨Ž°úžĄú, žä§ŪÉÄŪčīžĚĄ žā¨žö©ŪēėžßÄ žēäžēėŽč§ ŪēīŽŹĄ Í∑ł žßÄžÜć Ūö®Í≥ľŽ•ľ Žįįž†úŪē† žąė žóÜžúľŽĮÄŽ°ú ŪēīžĄĚžóź ŪēúÍ≥ĄÍįÄ žěąŽč§Í≥† Ž≥łŽč§.
5. ŽáĆž†Ąž¶Ě ŪôėžěźžĚė žä§ŪÉÄŪčī Ž≥Ķžö© žčú Í≥†Ž†§žā¨Ūē≠
1) žĖīŽĖ§ žä§ŪÉÄŪčīžĚī žĘčžĚĄÍĻĆ?
Simvastatin, lovastatin, atorvastatin, fluvastatin, pravastatinžĚė kainic acid žú†Žįú ŽįúžěĎ žĖĶž†úŪö®Í≥ľŽ•ľ ŽĻĄÍĶźŪēú ŽŹôŽ¨ľžóįÍĶ¨ Í≤įÍ≥ľ simvastatinÍ≥ľ lovastatinžĚī ŽĻĄÍĶź žöįžúĄŽ•ľ Ž≥īžėÄÍ≥†,30 audiogenic seizure žú†Žįú žĖĶž†úŪö®Í≥ľŽäĒ lovastatinÍ≥ľ pravastatinžĚī atorvastatin, fluvastatin, simvastatinŽ≥īŽč§ žöįžąėŪēėžėÄŽč§.31 Í∑ł Ūö®Í≥ľžĚė žį®žĚīŽ•ľ žä§ŪÉÄŪčīžĚė Ūėąžē°ŽáĆžě•Ž≤Ĺ Ūą¨Í≥ľŽ†•žĚė žį®žĚīŽ°ú žĄ§Ž™ÖŪēėÍ≥† žěąžúľŽāė, ÍįĀÍįĀžĚė ŽŹôŽ¨ľžč§Ūóė Ž™®ŽćłÍ≥ľ ŽĻĄÍĶź žö©ŽüČžĚī Žč§Ž•īŽĮÄŽ°ú ŪäĻž†ē žä§ŪÉÄŪčīžĚė ŽįúžěĎ žĖĶž†ú ŽĻĄÍĶź žöįžúĄŽ•ľ Žč®ž†ēž†ĀžúľŽ°ú ŽßźŪēėÍłį ŪěėŽď§Žč§. žĶúÍ∑ľ ŽįúŪĎúŽźú žĘÖžĄ§ žóįÍĶ¨ŽäĒ žč¨ŽáĆŪėąÍīÄžßąŪôėžóźžĄú žė§Žěú žēĹŽ¨ľžā¨žö© Í≤ĹŪóėÍ≥ľ, Ž∂ÄžěĎžö©žóź ŽĆÄŪēú ŪíćŽ∂ÄŪēú ŽćįžĚīŪĄį, Žėź ŽáĆž†Ąž¶Ě Ž∂ĄžēľžóźžĄúžĚė ŪõĄŪĖ•ž†Ā žä§ŪÉÄŪčīžĚė Ūö®Í≥ľ Í≤įÍ≥ľŽ•ľ ŽįĒŪÉēžúľŽ°ú atorvastatinžĚĄ ÍįÄžě• ž†Āžö© ÍįÄŽä•žĄĪžĚī ŽÜížĚÄ žēĹžúľŽ°ú ž£ľžě•ŪēėžėÄŽč§.32
2) žö©ŽüČžĚÄ žĖīŽĖĽÍ≤Ć Ūēīžēľ ŪēėŽāė?
ŽŹôŽ¨ľžč§ŪóėžóźžĄú ŽįúžěĎ žĖĶž†úŪö®Í≥ľÍįÄ atorvastatin 5 mg/dayŽäĒ žóÜžóąÍ≥† 10 mg/dayžóźžĄú ŽāėŪÉÄŽāė, žä§ŪÉÄŪčīžĚė ŽįúžěĎ žĖĶž†úŪö®Í≥ľŽäĒ žö©ŽüČ žĚėž°īž†ĀžĚīžóąŽč§.6 žěĄžÉĀžóįÍĶ¨žóźžĄúŽŹĄ žö©ŽüČ žĚėž°īž†ĀžĚł Ūö®Í≥ľÍįÄ ž¶ĚŽ™ÖŽźėžóąŽäĒŽćį, 1,033Ž™ÖžĚė ŪóąŪėąžĄĪ ŽáĆž°łž§Ď ŪôėžěźŽ•ľ ž†ĄŪĖ•ž†ĀžúľŽ°ú ŪĎúž§Ä žö©ŽüČÍ≥ľ 2Žįį žö©ŽüČžĚė žä§ŪÉÄŪčīÍĶįžúľŽ°ú ÍĶ¨Ž∂ĄŪēėžó¨ 18ÍįúžõĒÍįĄ ÍīÄžįįŪēėžėĞ̥ ŽēĆ, ŪĎúž§Ä žö©ŽüČÍĶįžĚÄ 2.54%žĚė ŪôėžěźžóźÍ≤Ć ŽáĆž°łž§Ď ŪõĄ ŽáĆž†Ąž¶ĚžĚī ŽįúžÉĚŪēú Žćį ŽįėŪēī, 2Žįį žö©ŽüČÍĶįžóźžĄúŽäĒ 0.41%ŽßĆ ŽįúžÉĚŪēėžėÄŽč§.33 20,858Ž™ÖžĚė ŽáĆÍ≤ĹžÉČ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú ŽáĆž°łž§Ď ŪõĄ ŽáĆž†Ąž¶Ě ŽįúžÉĚŽ•†ŽŹĄ ž†Äžö©ŽüČÍ≥ľ Í≥†žö©ŽüČžĚė žä§ŪÉÄŪčīÍĶį ÍįĄžóź žĚėŽĮł žěąŽäĒ Ūö®Í≥ľ žį®žĚīŽ•ľ Ž≥īžėÄŽč§.34 ÍįôžĚÄ Í∑łŽ£ĻžóźžĄú 7,435Ž™ÖžĚė ŽáĆ Žāīž∂úŪėą ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú žóįÍĶ¨ŽŹĄ ÍįôžĚÄ Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§.35
3) žä§ŪÉÄŪčīÍ≥ľ ŽįúžěĎ žĖĶž†úž†ú(antiseizure medication)žĚė žÉĀŪėłÍīÄÍ≥Ą
1žĄłŽĆÄ ŽįúžěĎ žĖĶž†úž†úŽäĒ ŽßéžĚÄ žēĹžĚī cytochrome P450žĚĄ žú†ŽŹĄŪēėÍ≥†, žĚīžóź žĚėŪēī Ūėąž§Ď žĹúŽ†ąžä§ŪÖĆŽ°§žĚė ŽÜ掏ĄŽ•ľ žÉĀžäĻžčúžľú žč¨ŪėąÍīÄÍ≥Ą žßąŪôėžĚė žúĄŪóėžĄĪžĚĄ ŽÜížĚłŽč§.36 žĚīŽü¨Ūēú žĚīžú†Ž°ú 2žĄłŽĆÄ ŽėźŽäĒ 3žĄłŽĆÄ ŽįúžěĎ žĖĶž†úž†úŽ°ú ÍĶźž≤īŪēėÍĪįŽāė, Ūėąž§Ď žĹúŽ†ąžä§ŪÖĆŽ°§žĚĄ Žāģž∂ú Ž™©ž†ĀžúľŽ°ú žä§ŪÉÄŪčīžĚĄ Ūą¨žó¨ŪēėÍłįŽŹĄ ŪēúŽč§. Í∑ł žôłžóźŽŹĄ ŽáĆž†Ąž¶Ě ŪôėžěźžóźžĄú žč¨ŽáĆŪėąÍīÄžßąŪôė žúĄŪóėžĚī ŽÜíÍĪįŽāė žä§ŪÉÄŪčīžĚĄ Ūą¨žó¨ŪēėÍ≥† žěąŽäĒ ŽáĆÍ≤ĹžÉČ ŪôėžěźžóźžĄú ŽáĆž†Ąž¶ĚžĚī ŽįúžÉĚŪēėŽäĒ Í≤ĹžöįŽŹĄ ŽßéžēĄžĄú, žä§ŪÉÄŪčīÍ≥ľ ŽįúžěĎ žĖĶž†úž†ú ÍįĄžĚė žÉĀŪėł žėĀŪĖ•žĚĄ žĚīŪēīŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėŽč§.
žä§ŪÉÄŪčī žā¨žö© žÉĀŪÉúžóźžĄú ŽįúžěĎ žĖĶž†úž†ú, ŪäĻŪěą Ūö®žÜĆžú†ŽŹĄ(enzyme-inducing) ŽįúžěĎ žĖĶž†úž†úŽ•ľ Ūą¨žó¨ŪēėŽ©ī, ŽĆÄÍįú žä§ŪÉÄŪčīžĚė Ūö®Í≥ľÍįÄ ÍįźžÜĆŪēúŽč§. 1žĄłŽĆÄ ŽįúžěĎ žĖĶž†úž†ú ž§Ď carbamazepine, phenytoin, phenobarbital, primidone, 2žĄłŽĆÄ ž§ĎžóźžĄúŽäĒ oxcarbazepine, 3žĄłŽĆÄ ž§ĎžóźžĄúŽäĒ eslicarbazepine, rufinamideÍįÄ cytochrome 3A4žĚĄ žú†ŽŹĄŪēėŽäĒŽćį, žĚīŽ°ú žĚłŪēī 3A4Ž°ú ŽĆÄžā¨ŽźėŽäĒ žä§ŪÉÄŪčīžĚł simvastatin, atorvastatin, lovastatinžĚÄ ŽÜ掏ĄÍįÄ ÍįźžÜĆŪēúŽč§.37,38 ŪēúŪéł Dravet ž¶ĚŪõĄÍĶįžĚė žĻėŽ£Ćž†úžĚł stripentolžĚÄ 3A4žĚė žĖĶž†úŪö®Í≥ľÍįÄ žěąŽč§.
ŽįúžěĎ žĖĶž†úž†úŽ•ľ žā¨žö©ŪēėŽäĒ žÉĀŪÉúžóźžĄú žä§ŪÉÄŪčīžĚĄ Ūą¨žó¨ŪēėžėĞ̥ ŽēĆŽäĒ ŽįúžěĎ žĖĶž†úž†úžĚė ŽÜ掏ĄÍįÄ žÉĀžäĻŪē† žąė žěąŽč§.31,37 Í∑ł Íłįž†ĄžĚÄ Í≤ĹžüĀž†ĀžĚł ŽĆÄžā¨ÍīÄÍ≥Ą ŽēĆŽ¨łžĚľ žąėŽŹĄ žěąÍ≥†, Žč®ŽįĪžßą Í≤įŪē©žóź ŽĆÄŪēú Í≤ĹžüĀžúľŽ°ú žěźžú† ŪėēŪÉúžĚė ŽįúžěĎ žĖĶž†úž†ú ŽÜ掏ĄÍįÄ žÉĀžäĻŪēėžó¨ ŽáĆ Žāī ŽÜ掏ĄŽ•ľ ŽÜížĚľ žąėŽŹĄ žěąÍ≤†žßÄŽßĆ, ž†ēŪôēŪēú Íłįž†ĄžĚÄ ŽįĚŪėÄž†ł žěąžßÄ žēäŽč§. Ž™®ŽĎź ŽŹôŽ¨ľžč§ŪóėžóźžĄúžĚė Í≤įÍ≥ľžĚīŽ©į, ŽáĆž†Ąž¶Ě žēĹŽ¨ľžĚė ŽÜ掏ĄÍįÄ ŽÜížēĄžßĄŽč§Í≥† ŪēėŽćĒŽĚľŽŹĄ žĚīÍ≤ÉžĚī ŽĀľžĻėŽäĒ žěĄžÉĀ žėĀŪĖ•žóź ŽĆÄŪēīžĄúŽäĒ žóįÍĶ¨ÍįÄ Ž∂Äž°ĪŪēėŽč§.
Í≤įŽ°†
Žč§žĖĎŪēú ŽŹôŽ¨ľžč§ŪóėŽď§žĚī žä§ŪÉÄŪčīžĚė ŽáĆž†Ąž¶Ě ŽįúžěĎ žĖĶž†úŪö®Í≥ľŽ•ľ Ž≥īžó¨ž£ľžóąÍ≥†, Í∑ł Íłįž†ĄžúľŽ°ú žĄ§Ž™Ö ÍįÄŽä•Ūēú Žč§žĖĎŪēú Ž∂ÄÍįÄŪö®Í≥ľÍįÄ ž¶ĚŽ™ÖŽźėžóąŽč§. ŽĆÄÍ∑úŽ™® ŪõĄŪĖ•ž†Ā žěĄžÉĀžóįÍĶ¨ Í≤įÍ≥ľŽŹĄ žä§ŪÉÄŪčīžĚė ͳȞĄĪŽįúžěĎ žĖĶž†úŪö®Í≥ľžôÄ, ŽáĆž†Ąž¶Ě ŽįúžÉĚ žėąŽį©Ūö®Í≥ľŽ•ľ Ží∑ŽįõžĻ®Ūēī ž£ľžóąŽč§. ŪēėžßÄŽßĆ, ž†Āž†ąŪēú žóįÍĶ¨ ŽĆÄžÉĀžěźžĚė Í∑úŽ™®žôÄ ŽáĆž†Ąž¶Ě žõźžĚł žßąŪôė, žä§ŪÉÄŪčī Ūą¨žó¨ žö©ŽüČ ŽįŹ žĘÖŽ•ėŽ•ľ ž†úžĖīŪēú ž†ĄŪĖ•ž†ĀžĚł Ž¨īžěĎžúĄ žóįÍĶ¨ŽäĒ ž†ĄŽ¨īŪēėŽĮÄŽ°ú, žä§ŪÉÄŪčīžĚė ŽáĆž†Ąž¶Ě žĻėŽ£ĆŪö®Í≥ľžóź ŽĆÄŪēú Í≥ľžč†žĚÄ žēĄžßĀ ÍłąŽ¨ľžĚīŽč§. Žėź, Í≥†žö©ŽüČ žä§ŪÉÄŪčī Ūą¨žó¨ žčú žėąžÉĀŽźėŽäĒ ÍįĄžÜźžÉĀ ŽėźŽäĒ Í∑ľžÜźžÉĀ žúĄŪóėžóź ŽĆÄŪēú žúĄŪóė-žĚīŽďĚžĚė Í≥†Ž†§ÍįÄ ŪēĄžöĒŪēėŽĮÄŽ°ú, ŽáĆÍ≤ĹžÉȞ̥ ŪŹ¨Ūē®Ūēú žč¨ŽáĆŪėąÍīÄ žĚīžÉĀžĚī žóÜÍ≥†, Í≥†žßÄŪėąž¶ĚžĚī žēĄŽčĆ ŽáĆž†Ąž¶Ě ŪôėžěźžóźžĄúžĚė Ūą¨žó¨žĚė ÍłįŽĆÄŪö®Í≥ľžóź ŽĆÄŪēīžĄúŽäĒ ž∂ĒÍįÄž†ĀžĚł žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėŽč§.